培養細胞のトランスフェクション効率の計測
トランスフェクションとは
トランスフェクション(transfection)とは核酸を動物細胞内へ取り込ませる手法で、特定の遺伝子を細胞に取り込ませて、目的とするたんぱく質を発現させる過程のことです。トランスフェクションによって取り込む核酸は「外来核酸」といわれ、ウイルスを介したDNA転移である形質導入と異なり、ウイルスを介することなく目的の細胞に遺伝子を取り込ませることができます。
取り込んだ核酸を一時的に存在させて発現させたり、取り込まれた宿主ゲノムが複製される際に同時に複製させたりすることができます。この、核酸を一時的に存在させるトランスフェクションを「一過性トランスフェクション」、同時に複製させるトランスフェクションを「安定トランスフェクション」と言います。これにより、特異的に導入細胞の遺伝子発現を増強したり抑制したり、組み換えたんぱく質の生成などが行えます。
トランスフェクションの原理
たんぱく質が取り込まれた脂質二重膜でできた細胞膜は負電荷を持ち、DNAやRNAなどの負電荷を持つ大きな核酸(分子)を通過させません。このため、トランスフェクションを可能にするには、何らかの方法で核酸が細胞膜を通過できるようにしなければなりません。核酸が細胞膜を通過できるようにする方法には、化学的手法・生物学的手法・物理学的手法があり、それぞれ原理が異なります。ここでは、それぞれの手法と原理、メリットとデメリットについて、細胞への遺伝子の取り込みを例に説明します。
化学的手法
化学的手法では、負に荷電した核酸に正電荷を与えるか負電荷を中和します。リポフェクション法、リン酸カルシウム共沈殿法などが知られていますが、なかでもリポフェクション法が一般的です。
リポフェクション法では、正荷電の合成脂質試薬の頭部基と負荷電の核酸との間の静電相互作用によって、カチオン性脂質試薬複合体が構成されます。カチオン性脂質試薬複合体は、負に帯電している細胞膜表面と相互作用し、細胞内へと効率的に核酸を導入することができます。これにより、核酸は細胞にエンドサイトーシスを媒介として取り込まれ、細胞質に放出されます。リポフェクション法は毒性が低く操作性に優れており、簡便にトランスフェクションを行うことが可能な手法です。
また、多くの種類の細胞系に対して効率よく核酸を取り込むことができ、たんぱく質やDNA、RNAの取り込みも可能です。さらに、一過性トランスフェクションと安定トランスフェクションの両方に対応できるというメリットがあります。
一方で、化学的手法は細胞のタイプや培養に適した条件設定が必要であるため、物理的手法や生物学的手法に比べて導入効率が低いというデメリットがあります。
生物学的手法
生物学的手法としては、ウイルスを使用したトランスフェクションが知られています。ウイルスによるトランスフェクションは、ウイルスの感染能力を利用していることから導入効率が高く、核酸の取り込みが困難な細胞でのたんぱく質過剰発現の方法としても活用されています。臨床研究において最も一般的な手法で、in vivoでのトランスフェクションに非常に適してします。in vivoでの遺伝子の取り込みにはアデノウイルスやレトロウイルス、レンチウイルスが用いられます。
このトランスフェクションでは、まず遺伝子をコピーする過程において組み換えウイルスを生成して、ヘルパー機能を持った遺伝子を導入した細胞を取り込んで増殖し、ウイルスベクターのみを抽出します。そして、組み込む遺伝子を含んだウイルスベクターを生成し、目的の遺伝物質を細胞に送り込みます。
ウイルスによるトランスフェクションは動物実験に用いられるなど生体への適応性が高い一方で、ウイルスの調製が難しくバイオセーフティレベルを適応させる必要があります。また、挿入変異や免疫による不活化もデメリットとして挙げられます。
物理的手法
物理的手法では細胞の表面に刺激を与え、細胞膜を透過して核酸を導入します。エレクトロポレーション法 (電気穿孔法)やマイクロインジェクション法、およびレーザー法などがあり、なかでもエレクトロポレーション法が一般的です。エレクトロポレーション法では、まず核酸と細胞を導電性溶液に懸濁または溶解して陽極と陰極ではさみ、電気パルスを連続的に与え細胞膜に小さな穴を作ります。そしてこの穴から、DNAやRNAのような電荷を持つ細胞外の核酸を細胞膜内に送り込みます。
物理的手法は、導入効率が高く、化学的手法や生物学的手法に比べて容易であるというメリットがあります。一方で、電気パルスで細胞が死んだり、電気パルスで開けた穴が塞がらなかったりという細胞毒性や、高価で特殊な装置が必要であるといったデメリットがあります。
トランスフェクション効率を上げるには
トランスフェクション効率とは、目的の細胞が核酸を取り込む効率のことです。ここでは、トランスフェクション効率を上げるにあたり、注意すべき点について説明します。
- 細胞生存率と継代処理:
- トランスフェクションを行う前の細胞生存率は90%以上が好ましいとされています。また、細胞を培養系から新しい培地に移す継代処理は、トランスフェクションを行う24時間以内に行います。ただし、過剰な継代はトランスフェクション効率に悪影響が出る可能性があるため、継代数には注意が必要です。
- 細胞の培養と試薬:
- トランスフェクションでの、最適な細胞の増殖状態を示す細胞占有面積率は、試験の目的や方法、細胞型などによって異なります。細胞占有面積は、高すぎると核酸の取り込みが不足したり、導入遺伝子の発現が減少したりします。また、低すぎると細胞間接触が起こらず増殖が進行しません。
トランスフェクションを行うために細胞を成長させる最適な培地は、細胞または試薬、細胞型の血清などによって異なります。たとえば、DNAを幹細胞に導入する場合は、ES細胞(Embryonic Stem cell:胚性幹細胞)やiPS細胞(induced Pluripotent Stem cells:人工多能性幹細胞)、ヒト成体幹細胞などに高効率かつ低毒性で核酸を導入できる試薬を用います。また、RNAを幹細胞に導入する場合は、幹細胞にsiRNA(small interfering RNA)やmRNA(メッセンジャーRNA)、dsRNA(double-stranded RNA)を分解から保護しつつ幹細胞に導入できる試薬を用います。 - トランスフェクション法の選択:
- トランスフェクションには化学的・生物学的・物理的などの方法があります。化学的方法や物理的方法は、培養細胞をターゲットとしたトランスフェクションに用いられます。生物学的方法は培養細胞や動物個体に効果的なトランスフェクション法です。しかし、化学的方法には細胞種や状態による導入効率の変動や化学毒性による影響、さらに特定細胞への選択的導入が困難であるなどのデメリットがあります。また、物理的方法には特殊な器具や装置が必要であることや、核酸が傷つきやすいといったデメリットがあり、生物学的方法には汚染の危険性や治療用の遺伝子が細胞の染色体に組み込まれる際に発生する挿入変異、免疫による不活化などの問題があります。
このように、トランスフェクション法は、導入する細胞とターゲットとなる細胞の組み合わせやデメリットなどに注意し、トランスフェクション効率が良く、再現性が高い方法を選択することが重要です。 - その他:
- 血清や抗生物質の使用/不使用もトランスフェクション効率に影響します。たとえば、DNAを取り込む場合、血清が存在する培地で細胞を培養すると効率良が上がります。また、抗生物質が存在する培地で一過性トランスフェクションを行うと、トランスフェクション効率を上げることができます。
一方で抗生物質は、細胞に有害な影響を及ぼす細胞毒性を発生させるため、トランスフェクション効率が低下する可能性があります。さらに一過性トランスフェクションではDNAベクターとRNAベクターの両方が使用できますが、安定トランスフェクションではDNAベクターのみが使用できます。
トランスフェクション効率の計測
トランスフェクションの効率を計測する方法の一つとして、蛍光顕微鏡を使用する手法が一般的です。観察された全細胞の数と蛍光発現した細胞数をカウントしスコアリングすることで、トランスフェクション効率を計測します。
トランスフェクション効率の計測方法
遺伝子導入時に細胞密度が適切になるように増殖用培地で調整した細胞懸濁液をウェルプレートに播種し、インキュベーターで培養します。そして、調製した複合体を細胞に添加しウェルプレートを振とうして再度インキュベーターで24時間培養します。培養が終わった細胞の発現活性を観察し、トランスフェクション効率を計測します。トランスフェクション効率の計測には、蛍光色素を用いた蛍光顕微鏡による観察が一般的です。
トランスフェクション効率計測の課題
従来の蛍光顕微鏡ではさまざまな問題があり、苦労することが多いのも事実でした。
まず、そもそも蛍光観察するために、暗室まで試料を持っていき、そこで実験を行う必要があるため、作業性が非常に悪いことがあげられます。また、細胞の輪郭を正確に抽出することが難しく、正確なカウントの妨げとなっていました。
さらに、実際にカウントして解析するためには、蛍光顕微鏡システムとは別のソフトを用意する必要があり、スムーズな解析が難しい、という声が多くありました。
オールインワン蛍光顕微鏡 BZ-X800は筐体内にブラックスペースを内蔵しているので、明るい部屋でも蛍光観察が可能です。輝度差の少ない培養細胞の位相差像も輪郭を正確に抽出して定量化でき、細胞をマスクして各マスク領域内にある測定対象の個数や⾯積率などの測定が可能。別途ソフトを用意することなく、トランスフェクション効率の定量測定に欠かせない細胞の発現量の計測を実現します。
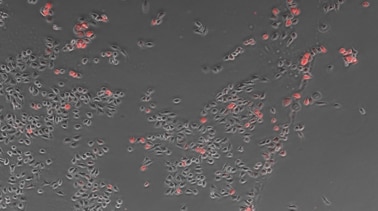


- 細胞
- 903個
- 発現
- 89個
- 効率
- 9.9%
使用対物レンズ:CFI Plan Fluor DL 10x
オールインワン蛍光顕微鏡 BZ-X800を導入すれば
- 暗室不要でいつでもどこで気軽に蛍光観察が可能です。さらに、きわめて褪色しにくい独自の原理を使い、細胞へのダメージを最小限にできます。
- 位相差と蛍光のオーバーレイ画像を取得することができます。
- 位相差画像でも独自のアルゴリズムを用いて、細胞の輪郭を正確に抽出できます。
- ハイブリッドセルカウントを使用して、細胞をマスクとして、細胞の中に含まれる蛍光蛋白を抽出し、カウントすることができます。