微生物(細菌)のLIVE/DEAD試験(生/死試験)
微生物(細菌)研究の主な目的
微生物(細菌)を研究することは、食品や化粧品、製薬産業をはじめ、医療衛生や環境モニタリングなどにおいて非常に重要です。その中でも微生物(細菌)の生存率は、食品や飲料、医薬品等の品質評価や防腐剤等の性能評価、消毒法の有効性の判定、抗菌材の開発などにおいて重要なパラメータとなっています。
微生物(細菌)の主な観察方法
微生物(細菌)の生存率を評価する手法としては、これまでは寒天培地上で微生物(細菌)を培養して形成されるコロニー(集落)の数をカウントする方法が一般的でした。しかしコロニー形成まで待たなければならず時間を要し、評価n数を増やすのが困難であることや、生存可能ではあっても培養できない微生物(細菌)には使用できないなどの問題がありました。
また、原子間力顕微鏡(AFM)や電子顕微鏡(SEM)を用いることで、形態学的変化などから微生物(細菌)の生存率に関する情報を得ることもできますが、高額な機器が必要である事や、観察にはサンプルの前処理が必要である点などから、ハイスループットスクリーニングへの適用が困難であるなどの問題があります。
そこで、より手軽に且つ短時間で効果が得られる方法として、光学的および染色を用いた観察手法が開発されるようになっています。微生物(細菌)のほとんどは、無色透明です。そのため、微生物(細菌)を観察して同定や判定、評価するには、透明なサンプルに適した観察・解析方法を実施する必要があります。ここでは、光学的および染色を用いた代表的な微生物(細菌)の観察・解析方法について解説します。
微分干渉観察(DIC)
- 微分干渉観察(DIC)とは
- 微分干渉観察(DIC:Differential Interference Contrast)とは、光路差を利用して無色透明なサンプルを観察する方法です。たとえば、透明な微生物(細菌)のサンプルに対して光が透過するとき、そのサンプルの部位による厚さと屈折率との違いにより、透過した光が進む距離(光路)の長さに差が生じます。これを光路差といいます。これによりサンプルの厚み部分の勾配にコントラストを付け、立体感のある像を得ることができます。また、影の付き方(コントラスト)は方向性を持ち、これを微調整して観察することも可能です。
- 微分干渉観察の仕組みと原理
- 微分干渉観察ができる顕微鏡には、コンデンサレンズ側と対物レンズ側の両方に微分干渉プリズム(DICプリズム)が搭載されています。そして、コンデンサレンズ側にポラライザー、対物レンズ側にはアナライザーと呼ばれる偏光板が、それぞれDICプリズムの外側に配置されています。光源から投光された光は、ポラライザーを透過することで、一方向に振動する「偏光」となります。偏光はコンデンサ側のDICプリズムで、振動する2本の偏光に分岐してサンプルに対してほぼ並行に照射されます。このとき、サンプルの厚みがある部位を透過した偏光と、そうでない部分を通過した偏光には、光路の違い(光路差)が生じます。サンプルを透過した2本の偏光は、対物レンズ側のDICプリズムで合流し、アナライザーを透過します。2本の偏光の光路差によって生じる干渉を明暗のコントラストとして観察することができます。
-
微分干渉観察の概要図 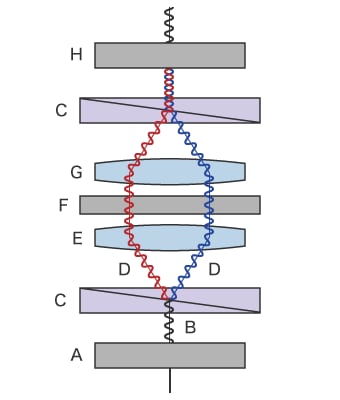
- A
- 偏光版(ポラライザー)
- B
- 照明光
- C
- DICプリズム
- D
- 2つに分かれた偏光
- E
- コンデンサレンズ
- F
- サンプル
- G
- 対物レンズ
- H
- 偏光版(アナライザー)
- 微分干渉観察の注意点
- プラスチック製の容器が光を受けると容器自体で偏光が生じるため、微分干渉観察にはガラス製のものを使用する必要があります。また、サンプルやレンズの汚れにもコントラストが付きノイズとなって表されるため、観察前に汚れを取り除いておく必要があります。さらに、観察像の影の付き方(コントラスト)には方向性があるため、サンプルをステージごと回転させ、コントラストの方向性を変えて観察することも大切です。
位相差観察
- 位相差観察とは
- 位相差観察とは、光源からの光がサンプルを通過するときの回折光*と直進光との位相のズレを利用した観察方法です。この位相のズレ(光路差)を明暗のコントラストに変換することにより、染色していない微生物(細菌)など透明なサンプルを観察することができます。
- 位相差観察の仕組みと原理
- 位相差観察を行うことができる顕微鏡には、光路上に位相板(フェーズプレート)とリングスリット(リング絞り)が配置されています。リングスリットが光源から出た光をリング状にします。リング状の光はコンデンサレンズやサンプルを経て、対物レンズ側にあるリング状の位相板を通ります。このとき位相板は、サンプル通過後の光の位相にズレを発生させます。
この光路上にサンプルを配置した場合、光がサンプルを通過する際、光の回折*により直進光と回折光*の2本にわかれます。位相の異なるこれらの光は対物レンズを介して位相板を通過するとき、波長の干渉によって互いに強め合う、または弱め合います。位相差観察では、こうした位相の差による干渉を物体像と背景の明暗として可視化して観察します。 - *光の回折(回折光)とは:光は波を持っているため、光路上に障害物(サンプル)があるとき、光の一部は直進せず障害物に回り込んで進む現象のことで、その光を回折光といいます。
-
位相差観察の概要図 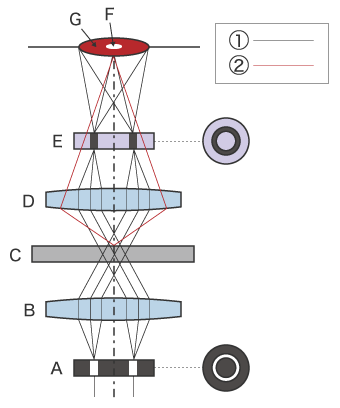
- ①
- 直進光
- ②
- 回折光
- A
- リングスリット(リング絞り)
- B
- コンデンサレンズ
- C
- サンプル
- D
- 対物レンズ
- E
- 位相板(フェーズプレート)
- F
- 物体像
- G
- 背景
- 位相差観察の注意点
- リングスリットの心出しが不十分な場合、位相板からリングスリットの光が漏れて直進光の位相変化が弱まり、それによってコントラストも弱くなります。また、サンプルによってプレパラートの状態が異なる場合、サンプル交換の都度リングスリットの心出し調整が必要になることがあります。
グラム染色
- グラム染色とは
- グラム染色とは、無色透明である微生物(細菌)を判定・同定するために用いられる染色法の一種です。微分干渉観察(DIC)や位相差観察のような光学的な手法とは異なり、試薬を用いて無色透明なサンプルを染色や脱色することにより、微生物(細菌)の細胞壁の構造や成分で染め分け、その色や形状などによって解析や判定を可能とします。
- グラム染色(食品の微生物検査)の手順の例
- グラム染色は、ハッカーの変法・フェイバー法・バーミー法の3種類が代表的です。中でも標準的とされるハッカーの変法を用いた食品の微生物検査(細菌検査)を例に、グラム染色の手順を解説します。
-
- 塗抹
- 脱脂後に滅菌精製水を載せたスライドグラスに、純培養菌を塗抹します。自然乾燥後、弱い火炎にスライドグラスの裏側を通します(火炎固定)。スライドグラスの裏側から洗浄(水洗)します。他の固定方法として、乾燥後にメタノールに浸すアルコール固定があります。
- 染色
- クリスタルバイオレット液(クリスタル紫液)をスライドグラスにかけて染色して洗浄し、次にルゴール液をかけて染色し、再び洗浄します。
- 脱色
- 95%エタノール(またはアセトン・アルコール)を使って脱色します。塗抹面にエタノールやアルコールなどが残らないよう、両面を丁寧に洗浄します。
- 後染色・乾燥
- サフラニン液(またはパイフェル液)を用いて後染色した後、再び洗浄します。標本に付着した水を切り、ろ紙で水分を取り除いてから、自然乾燥で完全に乾かします。
- 鏡検
- 一般的に油浸レンズを用いて、高倍率で鏡検します。
- 染色性や形状・形態などによる微生物(細菌)の判定
- グラム染色による染色性や形状による分類、微生物(細菌)などの属性推定や判定の例を紹介します。
-
微生物(細菌) 属性推定・判定例 染色性 グラム陽性菌 青に染まる(細胞壁が厚く脱色されにくい)。 グラム陰性菌 赤に染まる(細胞壁が薄く脱色されやすい)。 形状・形態など グラム陽性球菌 ブドウの房状のブドウ球菌(Staphylococcus属)や、チェーン状の連鎖球菌(Streptococcus属)など。食中毒の原因菌として、黄色ブドウ球菌などがあります。 グラム陽性桿菌 松葉状や柵状、V字状、W字状などに並んで見えるコリネバクテリウム属 (Corynebacterium属)や、太い四角形や台形のように見えるバチルス属(Bacillus属)など。食中毒の原因菌として、ウエルシュ菌・セレウス菌・ボツリヌス菌などがあります。 グラム陰性球菌 多くの場合、喀痰など検出形態から感染症の原因となる微生物(細菌)が判定されます。 グラム陰性桿菌 太い菌の両端が濃く染色され他のグラム陰性桿菌と比べて大きい腸内細菌(大腸菌など)や、菌が細く比較的小さめなブドウ糖非発酵菌(緑膿菌など)が代表的です。食中毒の原因菌として、腸炎ビブリオ・サルモネラ・カンピロバクター・腸管出血性大腸菌・赤痢菌・コレラ菌などがあります。 - グラム染色の注意点
- 脱色のし過ぎなど脱色不良があると、グラム陰性/グラム陽性を適切に染め分けられない場合があり、判断ミスの原因となります。また、単一視野だけでは情報が不足し、適切な判断ができない場合があります。複数の視野を観察・解析して、総合的に判断することが重要です。
蛍光顕微鏡による微生物(細菌)の観察と定量解析
微生物(細菌)は、ほとんどの場合無色透明に見えるため、上記で紹介した微分干渉観察や位相差観察でコントラストを付けた像を観察することが一般的でした。また、菌数や染色性や形状・形態から評価を行うために、グラム染色による可視化も代表的な手法です。しかし、これらの手法では、顕微鏡の観察視野の微生物(細菌)数を目視でカウントしたり、撮像画面内に多数存在する微生物(細菌)の状態の評価や形状の確認を行ったりするには膨大な時間を要し、定量的な解析が困難です。そして、微生物(細菌)がどの程度の時間まで生きているか、また、時間経過により死んでいる微生物(細菌)との比率がどのように変化するか(LIVE/DEAD試験)など、経時的変化の確認は難易度が高いことも課題でした。
蛍光顕微鏡を活用した微生物(細菌)の観察と定量解析の課題解決
一般に食品や化粧品・医薬部外品における微生物試験は、生きた微生物(細菌)を対象とした試験です。生物顕微鏡の一種である蛍光顕微鏡は、蛍光抗体や蛍光たんぱく質を標識に用いることにより、微生物(細菌)の細胞やたんぱく質にダメージを与えることなく、生きたまま観察することができます。
キーエンスのオールインワン蛍光顕微鏡 BZ-Xシリーズは、微生物(細菌)を染色することなく観察することができるため、サンプルの準備工数を劇的に削減すると同時に、染色による微生物(細菌)へのダメージがありません。もちろん、グラム染色された微生物(細菌)であっても観察と定量解析、時系列計測を簡単に実現することができます。特に時間経過によって異なる複数枚の画像での菌数カウントなど、データが揃ってはじめて解析・評価が可能となる場面では、大幅な工数削減が可能となります。
また、化粧品・医薬部外品の界面活性剤・防腐剤などの評価や、食品の乳酸菌数の確認などに有効なLIVE/DEAD(生死)試験では、細胞膜を光らせて生きている微生物(細菌)を確認し、それらが死んだ場合に赤く表示させるといった輝度値変化で表現することができます。この輝度値変化をライブセルイメージング(生細胞イメージング・タイムラプスイメージング)で記録・表現したり、任意の時点でリアルタイムに観察・計測したりといった運用が可能です。
BZ-Xシリーズのこうした機能は、食品や化粧品および医薬部外品の微生物試験での定量解析・評価を容易にすることはもちろん、製品の耐腐食性や抗菌性、食品に含まれる乳酸菌や酵母などの働きを動画でわかりやすく表現できるため、消費者に対して訴求力の高い販促ツールとしても応用することができます。
さらに、BZ-Xシリーズは、筐体内に内蔵した暗室を利用して観察・解析できるため、別途暗室を用意する必要がありません。それにより、自社検査に導入する場合でも設置場所が限定されません。
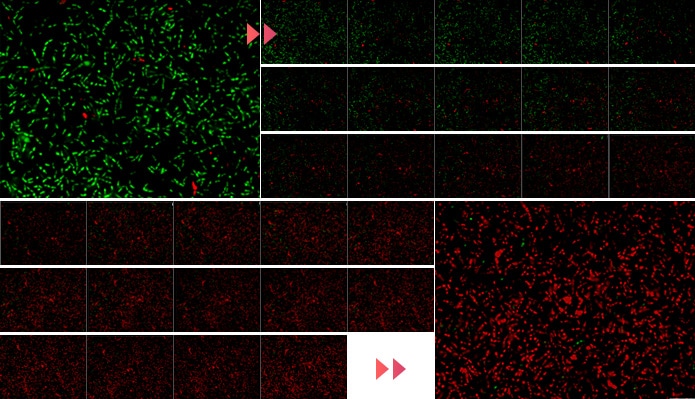
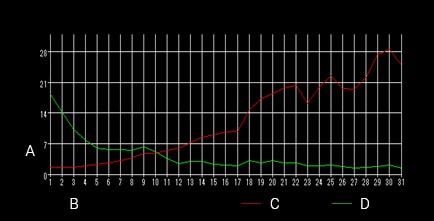
- A
- 輝度
- B
- 時間軸(枚数)
- C
- R輝度
- D
- G輝度
- 緑
- 生きているバクテリア
- 赤
- 死んでいるバクテリア
- 撮影間隔
- 20秒
- 撮影時間
- 10分
- オールインワン蛍光顕微鏡 BZ-Xシリーズを導入すれば
-
- 微生物(細菌)を染色することなく観察や定量解析が可能なため、サンプルの準備や解析の工数を削減し、染色によるサンプルのダメージがありません。
- グラム染色したサンプルにおいても時系列で得た複数枚の画像で微生物(細菌)の生死数を同時に計測し、解析・評価することができます。
- 細胞膜の輝度値変化から、生きている微生物(細菌)と死んでいる微生物(細菌)を色分けして表示できるため、Dead or Alive試験における生死の割合の変化を時系列計測での数値データやグラフ、動画として得ることができます。
- 微生物(細菌)の生死の割合の変化をわかりやすい動画で表現できるため、消費者に向けた製品販促に応用することもできます。
- 暗室が不要であるため、自社検査への導入時にも設置場所に困りません。