暗室不要の蛍光顕微鏡が研究を大きく変えた

- 佐谷 秀行 氏
-
慶應義塾大学 医学部教授
先端医科学研究所 遺伝子制御研究部門 医学博士1956年生まれ。87年、神戸大学大学院医学研究科博士課程修了。87年、医学博士号を取得後、カリフォルニア大学サンフランシスコ校の脳腫瘍研究センター研究員をはじめとして、88年、テキサス大学M.D.アンダーソンがんセンター助教授、94年、熊本大学医学部腫瘍医学講座教授を歴任。2007年、慶應義塾大学医学部附属先端医科学研究所教授に就任。専門は腫瘍生物学。これまでに、星野記念レクチャーシップ(2000年)やカーハルト記念レクチャーシップ(2000年)、デボラ・リッチマン記念レクチャーシップ(2001年)など、受賞多数。
- 人工がん幹細胞を用いて、がんの発生、転移のメカニズムを解明し、創薬に役立つ基盤の構築をめざす
- 01. がん幹細胞に着目した、がんの機構解明
- 02. 分子標的という概念に基づく治療法の探究
- 03. 細胞を基盤とした薬剤スクリーニング
- 04. 人工がん幹細胞(iCSC)の作製に成功
- 05. 暗室不要の蛍光顕微鏡が研究を大きく変えた
- 06. 研究の効率化に貢献しているBZシリーズ
- 07. 『ヘイズリダクション』機能でクリアな画像に
- 08. 論文用の画像はすべてBZシリーズで撮影
- 09. がん治療のあり方を大きく変えていく可能性
- <豆知識> 人工がん幹細胞(iCSC)
人工がん幹細胞を用いて、がんの発生、転移のメカニズムを解明し、創薬に役立つ基盤の構築をめざす
発がんと悪性化の分子機構をテーマに掲げ、最先端のがん治療を探究している慶應義塾大学医学部の先端医科学研究所、遺伝子制御研究部門。初代教授である佐谷秀行氏がめざすのは、先端的な基礎研究で培った知識と技術を臨床医学に応用することで、がんを中心とする難治性疾患の予防・診断・治療に貢献することだ。分子標的を中心とした生物学的なアプローチによって、脳腫瘍をはじめとするがんの治療に向けた基礎研究に注力している。
01. がん幹細胞に着目した、がんの機構解明
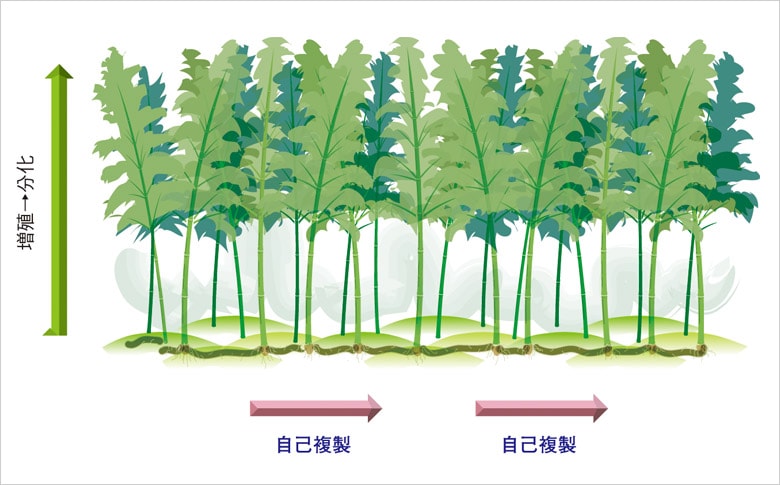
がんとは、増殖能力を持った細胞において、がん抑制遺伝子やがん遺伝子の変化によって遺伝子が不安定なものとなった結果、増殖停止や細胞死、老化などの機構に異常が生じたことによって発生する疾患とされる。
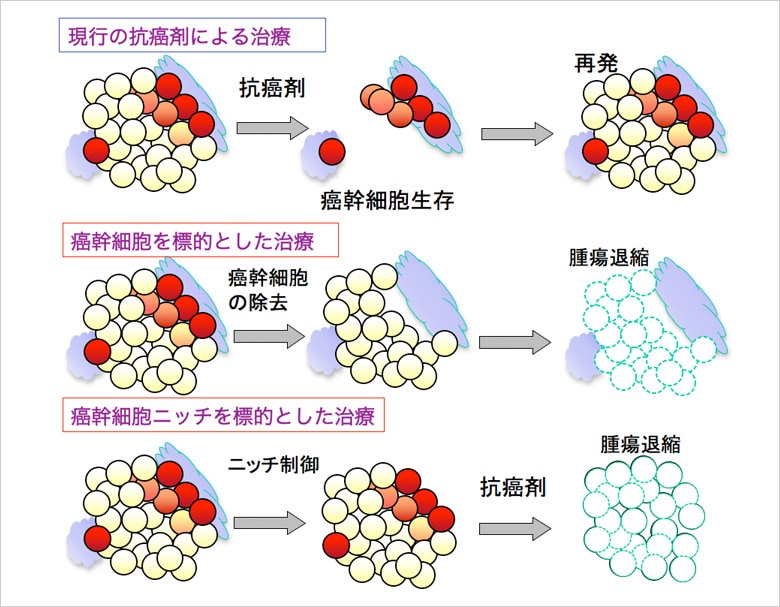
従来、がんの組織は永続的に増殖し続ける細胞の塊ととらえられてきたが、近年の研究を通じて2つのタイプのがん細胞があることが判明している。一つは、自己複製機能を持ち、半永久的に子孫の細胞をつくり続けるもので、いわば「がん幹細胞」。そして、もう一つが最終的には増殖機能を失う大多数の細胞である。つまり、正常な状態の幹細胞と前駆細胞のような関係が、がん細胞にもあることが分かってきた。
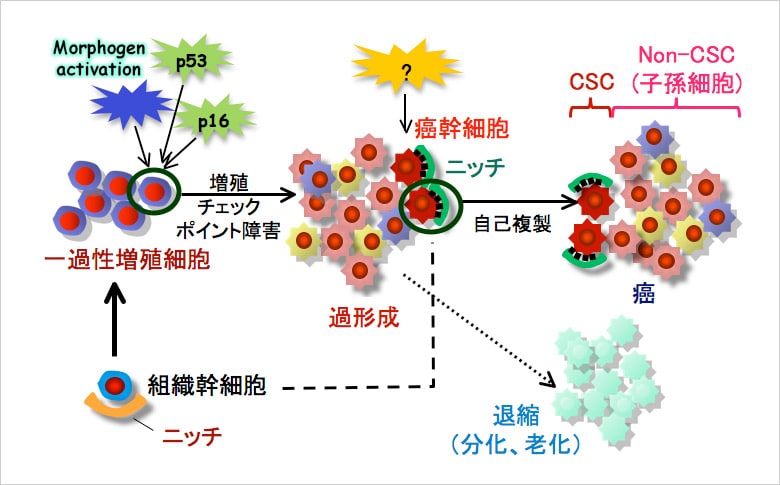
がん幹細胞の性質として、細胞周期が遅いため、抗がん剤や放射線照射に対する感受性が低く、治療しにくい点が挙げられる。そのため、薬剤治療などによって大多数のがん細胞が死滅しても、がん幹細胞が生き残ってしまう。それががんの根治に至らないという問題につながっている。
そこで、慶應義塾大学医学部教授の佐谷秀行氏は、細胞周期制御機構および細胞接着制御機構などを細胞生物学的手法を用いて詳細に解析し、その結果について動物モデルを用いて検証することにより、がんの発生や浸潤、転移のメカニズムを分子レベルで解明しようと研究に取り組んでいる。
02. 分子標的という概念に基づく治療法の探究
佐谷氏は神戸大学医学部を卒業後、脳腫瘍の治療を行う脳神経外科の臨床医をめざした。しかし、悪性脳腫瘍の場合、95%の患者が2年以内に亡くなるという現実に直面。現状では薬や手術による治療には限界があることから、自ら治療法を見つけるべく、大学院での研究の道を選んだ。しかし、「大学院では博士号の学位は取ったものの、治療法については皆目分からないまま」だったそうで、脳腫瘍を克服するには高い壁があることを思い知ったという。
1987年、大学院の博士課程修了にともない、米国・カリフォルニア大学・サンフランシスコ校の脳腫瘍研究センターに留学。当時、世界で最先端のがん治療法を研究していたことから、最新の知見を得られるのでは、と考えたからだ。ここでは、脳腫瘍の遺伝子解析を手がけ、治療のきっかけとなる標的分子の探索に力を注いだ。「分子標的」という概念は当時まだ先進的なもので、その後の研究につながる重要な示唆を得たという、
さらに、翌年にはテキサス大学M.D.アンダーソンがん研究センターの神経腫瘍部門の助教授に就任。全米で最大のがん治療機関だったことから、脳腫瘍をはじめとして幅広い部位のがん研究に携わった。
その後、94年に熊本大学に腫瘍医学講座という腫瘍の基礎研究を専門とした講座が誕生したのに伴い、初代教授として招聘された。
画像は『佐谷秀行:細胞工学 (2008) 27: 686-689より転載』
ここでまず手がけたのが、脳腫瘍をはじめとする種々のがんの細胞周期に関する研究だ。細胞周期とは、分裂で生じた娘細胞が母細胞になって、さらに分裂して新たな娘細胞になるまでの過程。がん細胞における周期のメカニズムを解明することで、がん細胞の増殖を食い止める可能性があると着目したのである。そこで、細胞分裂の様子をタイムラプスで観察する手法をいち早く取り入れ、基礎研究を徹底的に行った。それというのも、米国留学を通じて、「基礎研究なしに応用ばかりに目を向けていては、創薬研究は必ずといってよいほど崩壊する」事例をいくつも目の当たりにしてきたからだ。
03. 細胞を基盤とした薬剤スクリーニング
佐谷氏は、前述の細胞分裂期のメカニズムに標的を絞った創薬の研究で大きな成果を挙げているとともに、細胞接着分子CD44の研究でも著名だ。CD44は細胞同士を接着する分子だが、佐谷氏の研究によると、腫瘍が転移する上でのキー分子と考えられている。これを制御することでがんの浸潤、転移をブロックできる可能性があるとされる。
世界のがん研究をリードする、これら2本立ての研究を踏まえて佐谷氏がめざすゴールは、脳腫瘍など難治性のがんの治療に効く分子標的薬の開発だ。この分野の研究は世界中で徐々に進んでいるものの、生体に近い条件で薬剤の効果をテストするシステムはまだどこの研究機関でも確立しているわけではない。「培養した腫瘍の株をもとにin vitro※で実験してみると、効果があることが分かっているのですが、人体では本当のところどうなのか、という点が今、最大の研究テーマです。この壁を克服できれば、後は創薬に向けたスクリーニングへと一気に進むことができます」
もっとも、生体類似モデルでの研究は容易ではない。単純に言えば、細胞培養プレートの環境は2次元であるに対して生体は3次元。しかも後者では、様々な構造が入り混じって存在し、がん細胞が隠れる場所が豊富にあるため、部位によって薬剤の効果が異なるからだ。この「不均一性」という問題をどうクリアするかが、大きな問題となっている。つまり、生体に近い環境を細胞を用いてin vitroでいかに再現するかが研究のポイントなのである。
従来、ある酵素に対する阻害剤をつくる際、酵素だけを試験管に入れてスクリーニングするのが一般的であった。これに対して、佐谷氏の研究室ではセル(細胞)ベースで薬剤の効果を試している。細胞を特殊な条件で培養し生体で生じる病的状態を再現し、化合物による変化を観察するという手法である。近年、佐谷氏の取り組みに代表されるように、創薬のあり方は大きく変貌しつつある。現在では「エンザイム(酵素)を基盤としたものから、細胞を基盤とした薬剤スクリーニングへと変わってきている」と佐谷氏は指摘する。
※in vitro:イン・ビトロ。試験管内の実験環境のこと。対比する概念としてin vivo(イン・ビーボ。生体内での環境)がある。
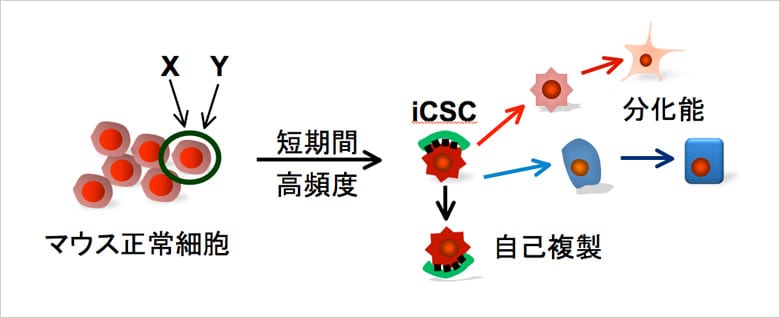
04. 人工がん幹細胞(iCSC)の作製に成功
佐谷氏が取り組んでいる最新の研究が、科学技術振興機構の戦略的創造研究推進事業(CREST)で採択された「人工がん幹細胞を用いた分化制御異常解析とがん創薬研究」だ。佐谷氏はiPS細胞の作製技術を応用することで、マウスの正常細胞に特定の遺伝子操作を行い、自己複製能と分化能と腫瘍形成能を有する人工がん幹細胞(induced cancer stem cell:iCSC)へと誘導することに成功している。
今後は各種iCSCを用いて腫瘍形成の機構を探るとともに、腫瘍形成を制御できる化合物、抗体などをスクリーニングすることを目的としている。現在はマウスを用いた研究だが、最終的には、がん治療創薬の標的として用いるために、ヒトの正常体細胞からのiCSCの作製をめざすという。
がん幹細胞の理論に基づく最新の研究では、子孫がん細胞とがん幹細胞を別々に狙った薬剤を用いることが考えられている。まず子孫がん細胞を治療薬で殺し、その後に従来、治療薬が効かなかったがん幹細胞を別の薬を狙い撃ちにするという治療法である。これによって、治療効果を劇的に高めることができるのではないかと考えられている。
05. 暗室不要の蛍光顕微鏡が研究を大きく変えた
がん治療において、セルベースの研究が重視される現在、「画像観察が重んじられ、顕微鏡の果たす役割はますます重要になっている」と、佐谷は指摘している。「がん細胞の変化をつぶさに観察するには立体的な観察が欠かせません。また、観察だけでなく、がん細胞の数をカウントすることによって、不均一性の確認が必要です。観察作業をスピーディにこなすとともに、計測もできる顕微鏡が求められています」
佐谷氏は、学生時代からセルベースの研究を続けてきたことから、蛍光顕微鏡は必須の機器であったという。「毎日のように暗室にこもって3時間以上、観察していました。細胞の絵をスケッチするのに、ポケットライトで手元を照らしながら描いたものです。しかし、この作業は目が疲れる上に効率が悪いものでした」と、当時の苦労を述べている。
そのため、キーエンスの蛍光顕微鏡「BZシリーズ」を熊本大学時代にデモンストレーションで初めて見たときは驚いたそうだ。「接眼レンズではなく、モニターで観察できるというのはエポックメーキングなことでした。学生たちから使いたいという希望が多かったことで導入を決めたのです」
導入後、効果は早速表われた。「明視野で使えるので観察がとても楽になりました。また、モニターを大勢の学生と一緒に見ながら、重要な箇所を説明したり、実験についての指示を出せる点が大きなメリットでした。接眼レンズの顕微鏡ではまず考えられませんでした」と語っている。
近年、創薬のスクリーニングは化合物をあらかじめ絞り込んで行なう傾向にあるとはいえ、それでも候補数は数千から1万の規模におよび、効率的なスクリーニングが欠かせない。観察や撮影をスピーディに行えるかどうかは顕微鏡の良し悪しにかかっているといっても過言ではない。
なお、教育現場での情報共有を重視する佐谷氏は、モニター画面にクリアに写った細胞の画像などをあえて表示させておくという。これによって、研究室の学生が画面を必ず見ることで興味が湧き、「自分でもきれいな画像を撮ろう」という気づきにつながるのだそうだ。「画像を通じて研究成果を共有するということは、研究室全体のレベル向上につながると考えます」と佐谷氏は語る。
- BZシリーズがさらに進化して登場!
- キーエンスの最新型オールインワン蛍光顕微鏡「BZ-X800」についてカタログで詳しく見る
06. 研究の効率化に貢献しているBZシリーズ
佐谷氏が研究機器を選択する際の大きな基準は「研究のスピードアップに役立つか」という点。それとともに、研究室内で何人の研究員が使えるか、もしくは使いたいと思うか、を重視する。「その点、BZシリーズは室内でほとんどの研究員が使用しています。それと、稼働率が高い割に故障することがない点も評価できます」と述べている。
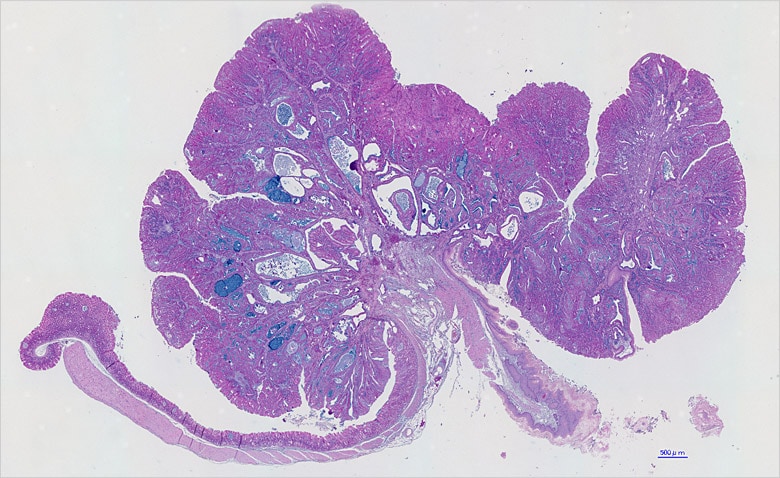
マウスを用いたがんの浸潤・転移の様子をセルベースで把握するには、臓器の連続切片を観察する必要がある。一つの臓器について20~30枚の切片標本をつくることになるが、「従来の接眼顕微鏡では短時間でとても観察しきれない数」という。それがBZシリーズを用いることで、約1時間程度で撮影を済ませることができる。

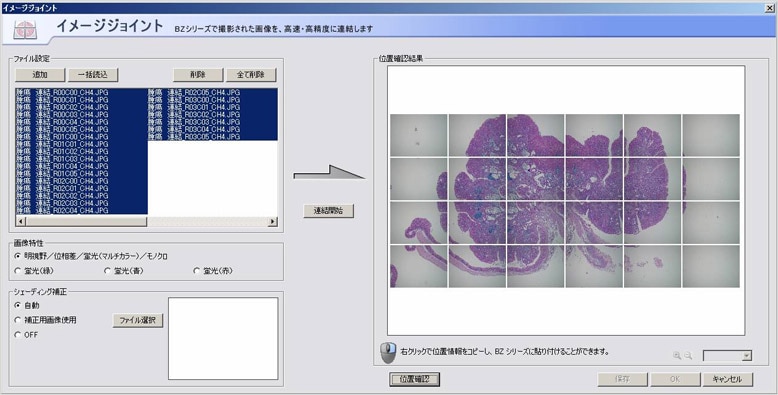
また、広域画像を撮影後に画像の張り合わせが素早く、しかも継ぎ目なしでできる「イメージジョイント」機能を佐谷氏は高く評価している。「学会で画像を発表すると、出席した先生方から撮影方法について質問を受けることがしばしばある」と語っている。
がん細胞の増殖の様子を詳しく知るためには、より生体に近い環境で立体的な観察が求められているが、その点、縦方向の観察に強い「XY・Z軸ステージ」が役立っているという。
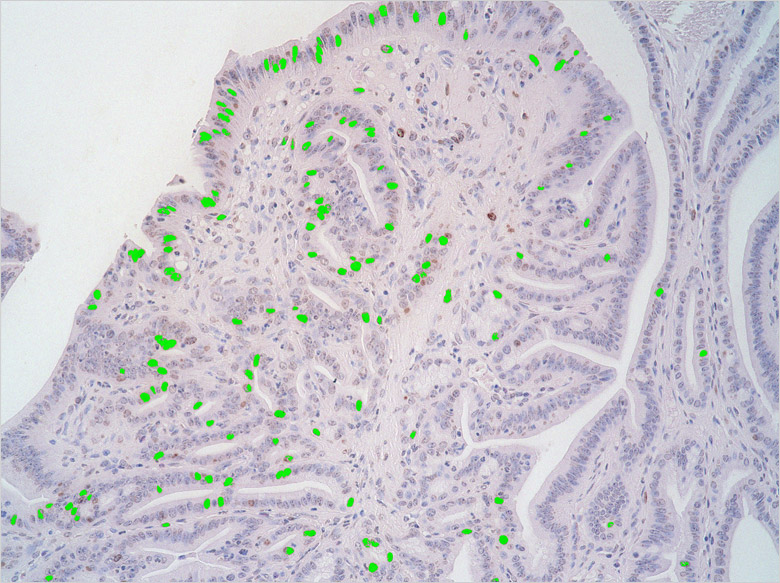
そのほか、一定の密度の中にどれだけのがん細胞があるかを計測するため、「セルカウント」機能を使用することが多いとのこと。観察内容を数値化することが求められる時代にあって、この機能はますます重要になっている。
- BZシリーズがさらに進化して登場!
- キーエンスの最新型オールインワン蛍光顕微鏡「BZ-X800」についてカタログで詳しく見る
07. 『ヘイズリダクション』機能でクリアな画像に
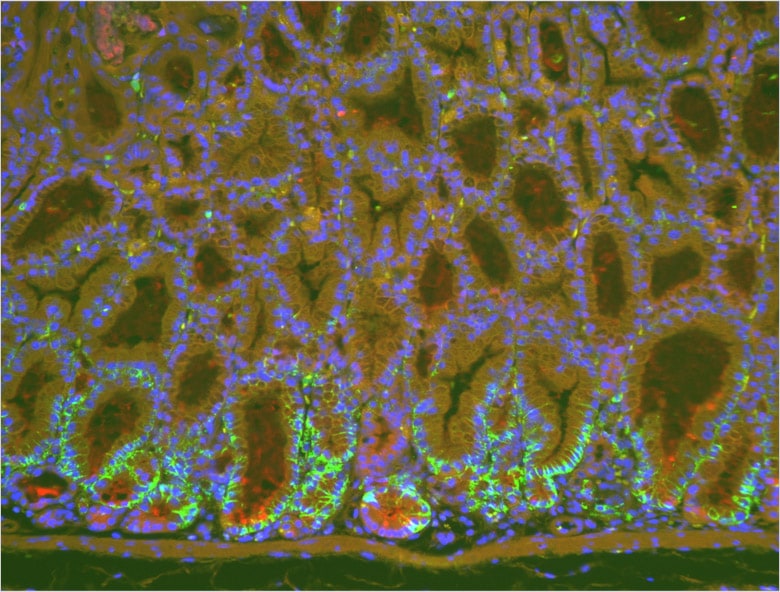
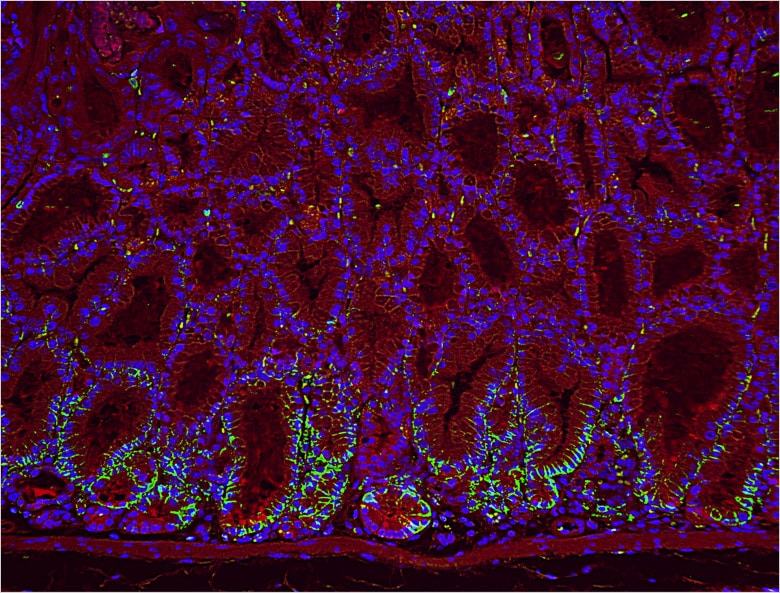
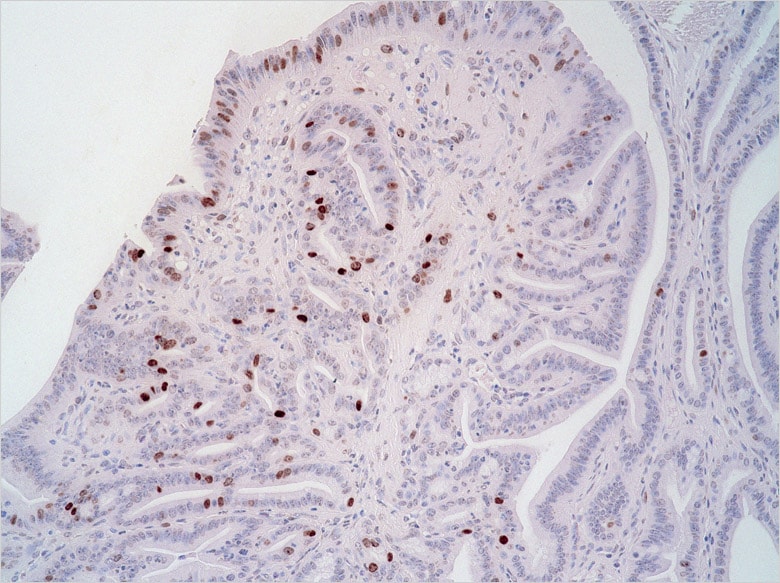
佐谷研究室にてBZシリーズを頻繁に使用しているのが、共同研究員の石本崇胤氏だ。現在、胃がんの発生に関する研究を手がけている。胃がんの原因として近年、ヘリコバクター・ピロリ(ピロリ菌)の関与が明らかになっているが、in vivoにおけるそのメカニズムについては完全に解明されたわけではない。石本氏はトランスジェニックマウスを用いた研究を通じて、胃がんが発生する分子レベルでのメカニズムを突き止めようとしている。

BZシリーズについては、マウスの胃の全体像および切片の観察に用いている。
「従来、組織切片の蛍光顕微鏡での観察というと、敷居が高くて気軽に使えるものではありませんでした。第一に、観察をしようとすると、試料の入ったプレパラートを持って、別棟にある暗室に駆けつける必要があったのです。これはなかなか面倒なこと。その点、BZシリーズは研究室内に設置でき、使いたいときにいつでも使用できて重宝しています」
石本氏は、実験が集中しているときはほぼ毎日のようにBZシリーズを使用するという。
「何といっても画像がきれいな点が魅力です。蛍光ボケを除去できる『ヘイズリダクション』機能は重宝しています。ポイントとなる細胞が発現している様子がはっきりと分かり、説得力のある画像にできると思います」
- BZシリーズがさらに進化して登場!
- キーエンスの最新型オールインワン蛍光顕微鏡「BZ-X800」についてカタログで詳しく見る
08. 論文用の画像はすべてBZシリーズで撮影
BZシリーズは研究の効率化という点でも役立っている、と石本氏は言う。「標的の細胞の数を数えるのに、『セルカウント』機能を活用しています。素早くカウントできる上、正確なのでとても便利です。それまではカウンターを握って一つひとつ手動で数えていましたが、これだと半日がかりの作業でした。セルカウントなら、あっという間に完了します」
このほか、ソフトウエアが操作しやすく、だれでも直感的に使いこなすことができる点も大きな魅力だという。
研究所内には共焦点顕微鏡も設置されているが、BZシリーズの導入以来、ほとんど使わなくなったとのこと。「共焦点は所内で共用のために事前に予約を入れる必要があることから、いつでもすぐにというわけにいきません。その点、BZシリーズは身近なところにあり、いつでも自由に使えます。それに研究に必要な観察、撮影、セルカウントといった作業をBZシリーズですべて済ませることができ、たいへん便利です」と、石本氏は利用のメリットを語る。
現在、学会発表用の論文を仕上げているという石本氏。発表に用いる画像はすべてBZシリーズで撮影した。
「胃がんをはじめとする消化器がんの発がんメカニズムは必ずしもよく分かっていません。その点、乳がんや白血病などは解明が進んでいます。私としては、消化器がんについて発生の仕組みを明らかにすることで、がん治療に役立ちたいと考えています」
- BZシリーズがさらに進化して登場!
- キーエンスの最新型オールインワン蛍光顕微鏡「BZ-X800」についてカタログで詳しく見る
09. がん治療のあり方を大きく変えていく可能性

佐谷氏が取り組んでいるiCSCを用いたセルベースの研究は、今後、がんに対する創薬スクリーニングの一般的な方法になる可能性を秘めている。また、がんに限らず、遺伝性疾患や代謝性疾患にも有望とされている。
そして、何よりもめざしているのは、脳腫瘍などの難治性がんの治療法を生み出すこと。「世界中、どこでも同じ薬剤治療ができる基盤を提供したいと考えます。脳腫瘍を経口薬で治療できるようにするのが私の夢」と抱負を語る。
iCSCを用いた最先端の研究が今後進むことで、がん発生のメカニズムが明らかにされ、がん治療のあり方を大きく変えていくことになるだろう。現在、死亡原因第一位のがんが、いずれは「死に至る病」でなくなる日がやってくるかもしれない。
(2009年3月現在)
<豆知識> 人工がん幹細胞(iCSC)
iPS細胞の作製技術を応用して、人工的に作製されたがん幹細胞。マウスの骨髄造血系細胞や骨髄間質細胞に遺伝子操作を加えることで、悪性腫瘍をつくる人工がん幹細胞(iCSC=induced cancer stem cell)を作製することが可能になっている。人工がん幹細胞は、がん治療に向けた創薬に大きく貢献するはずだ。また、iPS細胞の臨床応用に向けて問題となっているがん化の機構を解明する点でも、iCSCは役立つ可能性を秘めている。